学院动态
数理学院2022级硕士研究生胡丹在国际权威期刊Advanced Science上发表论文
来源:数理学院 浏览人数: 发布时间:2025-11-04

分子克隆技术的发展源于限制性内切酶的发现。该技术通常利用酶切位点将重组蛋白基因亚克隆至细菌表达载体,而这些位点会被保留在蛋白质编码序列中,进而在其天然序列的前后翻译产生额外的末端残基。本研究聚焦于一个关键但常被忽视的因素:酶切位点所引入的额外末端残基对蛋白质稳定性与动力学的调控作用。从进化视角看,蛋白质由短链无序肽演化而来,逐步获得功能复杂性与结构稳定性。
不同实验呈现出的折叠自由能的差异,默认是不同实验手段所致,以冷休克蛋白(Cold Shock Protein, CSP)为例,不同实验方法所测得的折叠自由能存在显著差异(约7.9–12.6 KBT)。我们研究发现,这种差异源于蛋白质两端残基的不同,或者是因实验需求所引入的其他额外结构元件。
为明确末端外残基的作用,我们设计不同的酶切位点在CSP两端引入不同的氨基酸残基,创建了三种构建体(LE-CSP-GS、KL-CSP-GS、KL-CSP-LE),利用单分子磁镊技术,系统比较了CSP构建体的折叠与去折叠动力学。结果显示,LE-CSP-GS的去折叠速率常数比其他构建体快一个数量级,而其折叠速率常数下降了一个数量级以上,导致其折叠自由能降低约5 KBT。进一步通过分子动力学模拟发现,稳定性差异主要源于残基K6与E56之间形成的额外氢键。
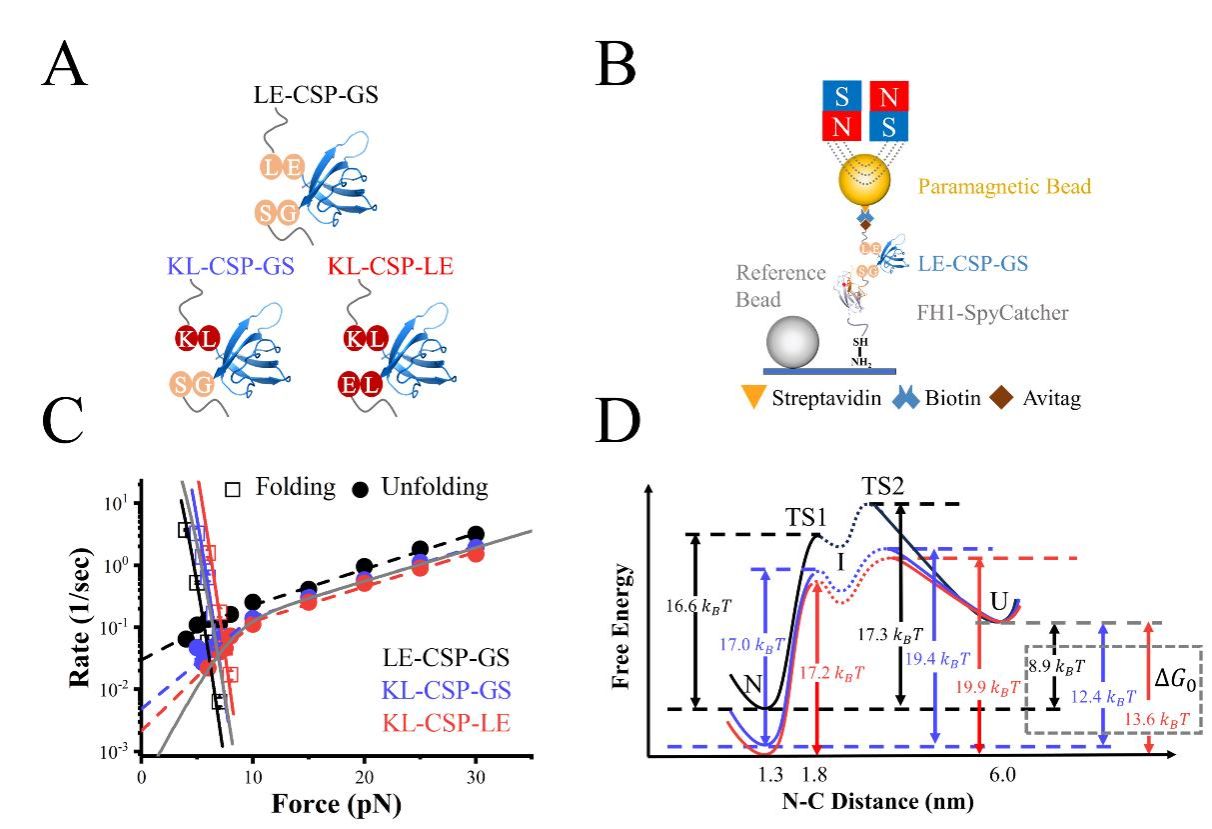
这项结合单分子实验与模拟的工作表明,N端和C端的额外氨基酸残基显著影响蛋白质的稳定性,这一结论在蛋白质设计上提供了一个新的策略。传统策略是通过突变蛋白质内部的氨基酸残基或重新设计蛋白质来提高蛋白质稳定性。而在端外引入残基来提高稳定性,在安全性和成本效益上更具有明显优势。
该成果以“Effect of Additional Terminal Residues on the Folding and Unfolding Dynamics of Cold Shock Protein”为题,发表在Advanced Science上(一区,IF=15)。数理学院2022级硕士研究生胡丹为论文第一作者。温州大学王艳伟副教授、厦门大学陈虎教授、国科温州研究院郭子龙副研究员为论文共同通讯作者,温州大学为第一通讯单位。相关工作得到国家自然科学基金和浙江省自然科学基金的支持。
DOI: 10.1002/advs.202501369





